
3Q validasi (IQ/OQ/PQ) adalah bagian inti dari validasi perangkat medis, bertujuan untuk secara sistematis memverifikasi kepatuhan dan keandalan seluruh proses dari produksi ke kinerja. Dalam hal berikut, kami menganalisis elemen utama dari 3Q verifikasi untuk karakteristik laparoskopi tunggalIrigasi dan alat penyedot, hindari mengutip data yang tidak dapat memastikan keakuratannya, dan optimalkan logika presentasi.

I. IQ (konfirmasi instalasi)
Tujuan: verifikasi bahwa peralatan produksi, lingkungan hidup dan sistem dokumentasi memenuhi persyaratan desain.
Faktor kunci:
Instalasi peralatan dan kalibrasi
Lokasi instalasi, konfigurasi sumber daya dan gas dari peralatan utama (misalnya, mesin pembuat injeksi, jalur perakitan) perlu mematuhi persyaratan dokumen teknis.
Kalibrasi sensor dan instrumen yang berhubungan dengan produksi (misalnya sensor tekanan, aliran meter, pengontrol suhu) untuk memastikan bahwa akurasi mereka memenuhi persyaratan proses.
Konfirmasi lingkungan produksi
Konfirmasikan bahwa kebersihan, temperatur, dan kelembapan kontrol terhadap lingkungan produksi memenuhi proses produk dan persyaratan peraturan (misalnya, untuk menghindari pencemaran dan risiko pencemaran lintas).
Catatan pemantauan lingkungan perlu lengkap, termasuk tetapi tidak terbatas pada kendali partikulat, muatan mikroba dan parameter dasar lainnya.
Dokumentasi Audit sistem
Konfirmasikan bahwa tata rias peralatan, catatan pemeliharaan, gambar desain dan tagihan materi (BOM) sudah lengkap dan dalam versi yang dikendalikan.
Tinjaulah kembali dokumen persyaratan pemasok material mentah (misalnya sertifikat berkualitas, laporan biokesesuaian) untuk memastikan kepatuhan rantai pasokan.
Ini. OQ (kualifikasi operasional)
Tujuan: untuk memverifikasi kemampuan peralatan dan proses untuk beroperasi secara stel di bawah parameter yang ditetapkan.
Faktor kunci:
Proses tes batas daerah
Verifikasi batas atas dan bawah dari parameter proses pembentukan injeksi (misalnya, suhu, tekanan, waktu) untuk memastikan bahwa silikon sepenuhnya divulkanized dan bebas dari cacat (misalnya, gelembung udara, di bawah vulcanisasi).
Test batch konsistensi produksi jamur multi-rongga untuk memastikan bahwa dimensi produk kritis (misalnya, diameter rongga, ukuran antarmuka) memenuhi persyaratan desain.
Validasi komponen fungsional
Tes pemeteraian: verifikasi kinerja pemeteraian penarik air melalui tes menahan tekanan untuk memastikan tidak ada kebocoran.
Validasi fungsi katup: uji kecepatan respon dan ulangi penggantian mode pembilasan/penyeimbang untuk memastikan keterandalan alat itu.
Kemampuan kontrol proses
Evaluasi stabilitas proses dari parameter proses kunci (misalnya, menganalisis distribusi data melalui metode statistik) untuk memastikan stabilitas proses.
Verifikasi keefektifan sistem inspeksi online (misalnya, inspeksi visual, uji tekanan) untuk memastikan kemampuan deteksi cacat.
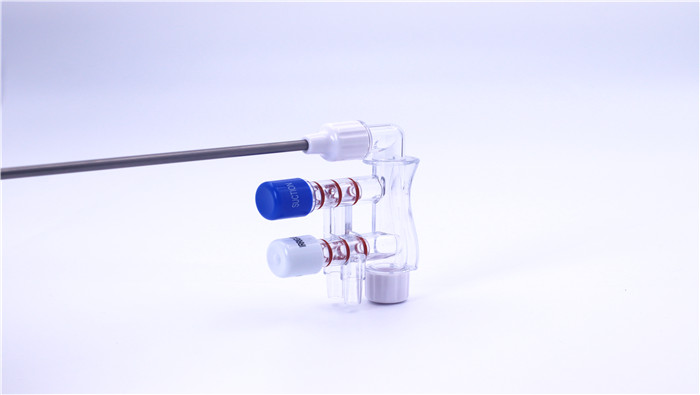
III. PQ (kualifikasi kinerja)
Tujuan: verifikasi bahwa kinerja produk akhir memenuhi kebutuhan klinis dan persyaratan regulasi.
Faktor kunci:
Penilaian biokompatibilitas
Lengkapi pengujian biokompatibilitas yang diperlukan menurut standar internasional (misalnya ISO 10993 seri), termasuk hal-hal dasar seperti sistoksisitas dan sensitivitas.
Verifikasi keamanan kimiawi (misalnya, penguraian, residu) dari komponen kontak pasien.
Sterilisasi dan validasi kemasan
Sterilisasi keabsahan: mengkonfirmasi tingkat jaminan kemandulan proses sterilisasi melalui bioindikator tantangan pengujian.
Pengendalian residu: pastikan agar residu sterilisasi (misalnya, etilena oksida) memenuhi persyaratan standar internasional yang relevan.
Pengemasan integritas: perbolehkan penyegel dan pembatas bakteri dalam pengemasan selama tanggal kedaluwarsa melalui tes penuaan yang dipercepat.
Pengujian simulasi fungsi klinis
Verifikasi kinerja cairan: simulasikan skenario pembedahan nyata untuk menguji stabilitas aliran pembilasan dan tekanan negatif.
Tes kelelahan: simulasikan beberapa skenario penggunaan (misalnya berulang menggunakan dan mencabut, penggantian mode) untuk memastikan keawetan instrumen.
Uji kondisi ekstrem: evaluasi keandalan instrumen di lingkungan yang tidak ideal (misalnya, suhu rendah, suhu tinggi).
Resiko manajemen dan sistem pelacak
Mengenali poin-poin risiko (misalnya kegagalan meterai, katup tertancap) melalui alat analisis risiko (misalnya FMEA) dan mengembangkan langkah-langkah kontrol.
Membangun sistem produksi komplasi untuk memastikan seluruh rantai dari bahan mentah sampai produk jadi.

IV. / integrasi dan keluaran 3Q verifikasi
Manajemen integritas Data
Pastikan bahwa semua data tes dapat dilacak dan dilihat ulang, selaras dengan prinsip-prinsip dasar integritas data (misalnya ALCOA).
Pelaporan dan tinjauan
Membuat laporan IQ/OQ/PQ validasi, penanganan penyimpangan dokumen dan tindakan perbaikan dan pencegahan (CAPA), dan disetujui oleh departemen kualitas.
Kemajuan yang berkesinambungan
Mengoptimalkan parameter proses atau rincian desain berdasarkan hasil validasi, pemutakhiran dokumentasi teknis dan dokumen manajemen risiko.
kesimpulan
Validasi 3Q dari irigasi laparoscopic dan perangkat penyedotan sekali pakai harus berpusat pada "peralatan kepatuhan - proses robustness - produk keandalan", dan intinya adalah untuk membuktikan keseluruhan kepatuhan desain, produksi dan kinerja melalui metode ilmiah. Perusahaan harus fokus pada kekakuan validasi logika dan menghindari mengandalkan
+86 18361958211
marketing@cndonho.com
+86 18361958211
No.2 Zhiwei Road, Qiandeng Town, Kunshan City, Jiangsu Province, China




